Jenis-jenis luka digolongkan berdasarkan : 1. Berdasarkan sifat kejadian, dibagi menjadi 2, yaitu luka disengaja (luka terkena radiasi atau bedah) dan luka tidak disengaja (luka terkena trauma). Luka tidak disengaja dibagi menjadi 2, yaitu : a. Luka tertutup : luka … Lanjutkan membaca
Arsip Kategori: KDK
Kisi-Kisi Soal UAS MK.KDK I
Kisi-Kisi Soal UAS MK. KDK I (Keterampilan Dasar Kebidanan) dapat diunduh pada link berikut:
Pemeriksaan Palpasi Leopold
Oleh: Gita Kostania
Pemeriksaan palpasi Leopold adalah suatu teknik pemeriksaan pada ibu hamil dengan cara perabaan yaitu merasakan bagian yang terdapat pada perut ibu hamil menggunakan tangan pemeriksa dalam posisi tertentu, atau memindahkan bagian-bagian tersebut dengan cara-cara tertentu menggunakan tingkat tekanan tertentu. Teori ini dikembangkan oleh Christian Gerhard Leopold. Pemeriksaan ini sebaiknya dilakukan setelah UK 24 minggu, ketika semua bagian janin sudah dapat diraba. Teknik pemeriksaan ini utamanya bertujun untuk menentukan posisi dan letak janin pada uterus, dapat juga berguna untuk memastikan usia kehamilan ibu dan memperkirakan berat janin.
Pemeriksaan palpasi Leopold sulit untuk dilakukan pada ibu hamil yang gemuk (dinding perut tebal) dan yang mengalami polihidramnion. Pemeriksaan ini juga kadang-kadang dapat menjadi tidak nyaman bagi ibu hamil jika tidak dipastikan dalam keadaan santai dan diposisikan secara memadai. Untuk membantu dalam memudahkan pemeriksaan, maka persiapan yang perlu dilakukan sebelum melakukan pemeriksaan adalah:
- Instruksikan ibu hamil untuk mengosongkan kandung kemihnya
- Menempatkan ibu hamil dalam posisi berbaring telentang, tempatkan bantal kecil di bawah kepala untuk kenyamanan
- Menjaga privasi
- Menjelaskan prosedur pemeriksaan
- Menghangatkan tangan dengan menggosok bersama-sama (tangan dingin dapat merangsang kontraksi rahim)
- Gunakan telapak tangan untuk palpasi bukan jari.
Gambar 1: Pemeriksaan Palpasi Leopold 1 s.d. 4
A. Pemeriksaan Leopold I
Tujuan: untuk menentukan usia kehamilan dan juga untuk mengetahui bagian janin apa yang terdapat di fundus uteri (bagian atas perut ibu).
Gambar 2: Palpasi Leopold 1
Teknik:
- Memposisikan ibu dengan lutut fleksi (kaki ditekuk 450 atau lutut bagian dalam diganjal bantal) dan pemeriksa menghadap ke arah ibu
- Menengahkan uterus dengan menggunakan kedua tangan dari arah samping umbilical
- Kedua tangan meraba fundus kemudian menentukan TFU
- Meraba bagian Fundus dengan menggunakan ujung kedua tangan, tentukan bagian janin.
Hasil:
- Apabila kepala janin teraba di bagian fundus, yang akan teraba adalah keras,bundar dan melenting (seperti mudah digerakkan)
- Apabila bokong janin teraba di bagian fundus, yang akan terasa adalah lunak, kurang bundar, dan kurang melenting
- Apabila posisi janin melintang pada rahim, maka pada Fundus teraba kosong.
B. Pemeriksaan Leopold II
Tujuan: untuk menentukan bagian janin yang berada pada kedua sisi uterus, pada letak lintang tentukan di mana kepala janin.
Gambar 3: Palpasi Leopold 2
Teknik:
- Posisi ibu masih dengan lutut fleksi (kaki ditekuk) dan pemeriksa menghadap ibu
- Meletakkan telapak tangan kiri pada dinding perut lateral kanan dan telapak tangan kanan pada dinding perut lateral kiri ibu secara sejajar dan pada ketinggian yang sama
- Mulai dari bagian atas tekan secara bergantian atau bersamaan (simultan) telapak tangan tangan kiri dan kanan kemudian geser ke arah bawah dan rasakan adanya bagian yang rata dan memanjang (punggung) atau bagian-bagian kecil (ekstremitas).
Hasil:
- Bagian punggung: akan teraba jelas, rata, cembung, kaku/tidak dapat digerakkan
- Bagian-bagian kecil (tangan dan kaki): akan teraba kecil, bentuk/posisi tidak jelas dan menonjol, kemungkinan teraba gerakan kaki janin secara aktif maupun pasif.
C. Pemeriksaan Leopold III
Tujuan: untuk menentukan bagian janin apa (kepala atau bokong) yang terdapat di bagian bawah perut ibu, serta apakah bagian janin tersebut sudah memasuki pintu atas panggul (PAP).
Gambar 4: Palpasi Leopold 3
Teknik:
- Posisi ibu masih dengan lutut fleksi (kaki ditekuk) dan pemeriksa menghadap ibu
- Meletakkan ujung telapak tangan kiri pada dinding lateral kiri bawah, telapak tangan kanan bawah perut ibu
- Menekan secara lembut dan bersamaan/bergantian untuk mentukan bagian terbawah bayi
- Gunakan tangan kanan dengan ibu jari dan keempat jari lainnya kemudian goyang bagian terbawah janin.
Hasil:
- Bagian keras,bulat dan hampir homogen adalah kepala sedangkan tonjolan yang lunak dan kurang simetris adalah bokong
- Apabila bagian terbawah janin sudah memasuki PAP, maka saat bagian bawah digoyang, sudah tidak bias (seperti ada tahanan).
D. Pemeriksaan Leopold IV
Tujuan: untuk mengkonfirmasi ulang bagian janin apa yang terdapat di bagian bawah perut ibu, serta untuk mengetahui seberapa jauh bagian bawah janin telah memasuki pintu atas panggul.
Gambar 5: Palpasi Leopold 4
Teknik:
- Pemeriksa menghadap ke arah kaki ibu, dengan posisi kaki ibu lurus
- Meletakkan ujung telapak tangan kiri dan kanan pada lateral kiri dan kanan uterus bawah, ujung-ujung jari tangan kiri dan kanan berada pada tepi atas simfisis
- Menemukan kedua ibu jari kiri dan kanan kemudian rapatkan semua jari-jari tangan yang meraba dinding bawah uterus.
- Perhatikan sudut yang terbentuk oleh jari-jari: bertemu (konvergen) atau tidak bertemu (divergen)
- Setelah itu memindahkan ibu jari dan telunjuk tangan kiri pada bagian terbawah bayi (bila presentasi kepala upayakan memegang bagian kepala di dekat leher dan bila presentasi bokong upayakan untuk memegang pinggang bayi)
- Memfiksasi bagian tersebut ke arah pintu atas panggul kemudian meletakkan jari-jari tangan kanan diantara tangan kiri dan simfisis untuk menilai seberapa jauh bagian terbawah telah memasuki pintu atas panggul.
Hasil:
- Apabila kedua jari-jari tangan pemeriksa bertemu (konvergen) berarti bagian terendah janin belum memasuki pintu atas panggul, sedangkan apabila kedua tangan pemeriksa membentuk jarak atau tidak bertemu (divergen) mka bagian terendah janin sudah memasuki Pintu Atas Panggul (PAP)
- Penurunan kepala dinilai dengan: 5/5 (seluruh bagian jari masih meraba kepala, kepala belum masuk PAP), 1/5 (teraba kepala 1 jari dari lima jari, bagian kepala yang sudah masuk 4 bagian), dan seterusnya sampai 0/5 (seluruh kepala sudah masuk PAP)
Menentukan usia kehamilan :
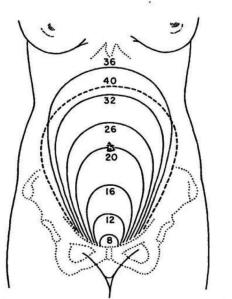
Gambar 6-7: Gambaran Tinggi Fundus Uteri (TFU) Dikonversikan dengan Usia Kehamilan (UK)
Keterangan:
- Pada usia kehamilan 12 minggu, fundus dapat teraba 1-2 jari di atas simpisis
- Pada usia kehamilan 16 minggu, fundus dapat teraba di antara simpisis dan pusat
- Pada usia kehamilan 20 minggu, fundus dapat teraba 3 jari di bawah pusat
- Pada usia kehamilan 24 minggu, fundus dapat teraba tepat di pusat
- Pada usia kehamilan 28 minggu, fundus dapat teraba 3 jari di atas pusat
- Pada usia kehamilan 32 minggu, fundus dapat teraba di pertengahan antara Prosesus Xipoideus dan pusat
- Pada usia kehamilan 36 minggu, fundus dapat teraba 3 jari di bawah Prosesus Xipoideus
- Pada usia kehamilan 40 minggu, fundus dapat teraba di pertengahan antara Prosesus Xipoideus dan pusat. (Lakukan konfirmasi dengan wawancara dengan pasien untuk membedakan dengan usia kehamilan 32 minggu).
Adapun tutorial pemeriksaan palpasi abdomen pada ibu hamil, dapat disimak sebagai berikut:
http://https://www.youtube.com/watch?v=wh7F-HygUpg&feature=youtu.be
Untuk Daftar Tilik Pemeriksaan Palpasi Leopold, dapat diunduh pada tautan berikut: Daftar Tilik Px Leopold – Upload
Artikel tentang pemeriksaan Denyut Jantung Janin, ada pada tautan berikut: https://oshigita.wordpress.com/2020/01/02/pemeriksaan-denyut-jantung-janin-pada-ibu-hamil/
Referensi:
Mochtar, Rustam, 1998. Sinopsis Obstetri; Obstetri Fisiologi-Obstetri Patologi. Jakarta : EGC.
Rachmawati, I.N., Budiati, T., & Rahmawati, C. 2008. Panduan Praktikum Prosedur Pemeriksaan Fisik Antenatal. Depok: UI.
http://en.wikipedia.org/wiki/Leopold’s_maneuvers
http://labspace.open.ac.uk/mod/oucontent/view.php?id=452288§ion=1.5.2
Pemeriksaan Tanda-Tanda Vital (Vital Sign)
Oleh: Gita Kostania
Pemeriksaan Tanda-Tanda Vital
- Pemeriksaan Tekanan Darah
- Pemeriksaan Suhu Tubuh
- Pemeriksaan Frekuensi Nadi
- Pemeriksaan Frekuensi Pernafasan
A. Pemeriksaan Tekanan Darah
Pemeriksaan tekanan darah merupakan suatu tindakan melakukan pengukuran tekanan darah, yaitu hasil dari curah jantung dan tahanan perifer, menggunakan Sphygmomanometer. Tekanan darah adalah tekanan yang ditimbulkan pada dinding arteri. Tekanan ini sangat dipengaruhi oleh beberapa faktor seperti curah jantung, ketegangan arteri, dan volume, laju serta kekentalan (viskositas) darah. Tekanan darah terjadi akibat fenomena siklis. Tekanan puncak terjadi saat ventrikel berkontraksi yang disebut tekanan sistolik. Sedangkan tekanan terendah terjadi saat jantung beristirahat yang disebut tekanan diastolik. Tekanan darah digambarkan sebagai rasio tekanan sistolik terhadap tekanan diastolic dengan nilai dewasa normalnya berkisar dari 100/60 sampai 140/90. Rata-rata tekanan darah normal biasanya 120/80.
Pemeriksn tekanan darah bertujuan untuk menilai system kardiovaskular/keadaan hemodinamik klien (curah jantung, tahanan vaskuler perifer, volume darah dan viskositas, dan elastisitas arteri). Pemeriksaan dilakukan pada setiap pasien yang masuk ke ruang pemeriksaan atau ruang perawatan, secara rutin pada pasien yang dirawat, dan sewktu-waktu sesuai kebutuhan. Hal-hal yang perlu diperhatikan adalah, hindari pemeriksaan pada ekstrimitas yang terpasang infus, trauma ataupun gips; apabila akan mengulang prosedur pemeriksaan, tunggu sekitar 30 detik sampai satu menit setelah skala nol; serta periksa terlebih dahulu arteri brachialis dengan tepat.
Tekanan darah dapat diukur secara langsung atau tidak langsung. Pada metode langsung, kateter arteri dimasukkan langsung ke dalam arteri. Pengukuran tidak langsung dilakukan dengan sfigmomanometer dan stetoskop.
Sfigmomanometer atau tensimeter dikenalkan pertama kali oleh dr. Nikolai Korotkov, seorang ahli bedah Rusia, lebih dari 100 tahun yang lalu. Tensimeter atau sphygmomanometer pada awalnya menggunakan raksa sebagai pengisi alat ukur ini. Sekarang, kesadaran akan masalah konservasi lingkungan meningkat dan penggunaan dari air raksa telah menjadi perhatian seluruh dunia. Bagaimanapun, sphygmomanometer air raksa masih digunakan sehari-hari bahkan di banyak negara modern. Sphygmomanometer terdiri dari sebuah pompa, sumbat udara yang dapat diputar, kantong karet yang terbungkus kain, dan pembaca tekanan, yang bisa berupa jarum mirip jarum stopwatch atau air raksa. Sfigmomanometer tersusun atas manset yang dapat dikembangkan dan alat pengukur tekanan yang berhubungan dengan rongga dalam manset. Alat ini dikalibrasi sedemikian rupa sehingga tekanan yang terbaca pada manometer sesuai dengan tekanan dalam millimeter air raksa yang dihantarkan oleh arteri brakialis. Agar sphygmomanometer masih dapat digunakan untuk mengukur tekanan darah dengan baik, perlu dilakukan kalibrasi. Cara melakukan kalibrasi yang sederhana adalah sebagi berikut:
- Sebelum dipakai, air raksa harus selalu tetap berada pada level angka nol (0 mmHg).
- Pompa manset sampai 200mmHg kemudian tutup katup buang rapat-rapat. Setelah beberapa menit, pembacaan mestinya tidak turun lebih dari 2mmHg (ke 198mmHg). Disini kita melihat apakah ada bagian yang bocor.
- Laju Penurunan kecepatan dari 200mmHg ke 0 mmHg harus 1 detik, dengan cara melepas selang dari tabung kontainer air raksa.
- Jika kecepatan turunnya air raksa di sphygmomanometer lebih dari 1 detik, berarti harus diperhatikan keandalan dari sphygmomanometer tersebut. Karena jika kecepatan penurunan terlalu lambat, akan mudah untuk terjadi kesalahan dalam menilai. Biasanya tekanan darah sistolic pasien akan terlalu tinggi (tampilan) bukan hasil sebenarnya. Begitu juga dengan diastolik.
Ukuran Manset
Pengukuran tekanan darah yang akurat tergantung pemakaian manset yang sesuai bagi pasien. Bila manset terlalu besar untuk lengan pasien, seperti pada anak-anak, maka pembacaannya akan lebih rendah dari tekanan sebenarnya. Bila manset terlalu kecil, misalnya pada penggunaan manset ukuran standar pada pasien obesitas, maka pembacaan tekanan akan lebih tinggi dibanding tekanan sebenarnya. Maka diproduksi berbagai ukuran manset untuk berbagai ukuran lingkar lengan.
|
Jenis Manset |
Lebar Kantong Karet (cm) |
Panjang Kantong Karet (cm) |
| Neonatus |
2.5 – 4.0 |
5.0 – 9.0 |
| Bayi |
4.0 – 6.0 |
11.5 -18.0 |
| Anak |
7.5 – 9.0 |
17.0 – 19.0 |
| Dewasa |
11.5 -13.0 |
22.0 – 26.0 |
| Lengan besar |
14.0 -150 |
30.5 – 33.0 |
| Paha |
18.0 -19.0 |
36.0 – 38.0 |
|
Tabel 1: Ukuran Manset |
||
Rentang Nilai Tekanan Darah
a. Neonatus dan Anak
|
Umur (Tahun) |
Sistole (mmHg) |
Diastole (mmHg) |
|
Neonatal |
75-105 |
45-75 |
|
2 – 6 |
80-110 |
50-80 |
|
7 |
85-120 |
50-80 |
|
8 |
90-120 |
55-85 |
|
9 |
90-120 |
55-85 |
|
10 |
95-130 |
60-85 |
|
11 |
95-135 |
60-85 |
|
12 |
95-135 |
60-85 |
|
13 |
100-140 |
60-90 |
|
14 |
105-140 |
65-90 |
|
Tabel 2: Rentang Nilai (Batasan Normal) Tekanan Darah pada Bayi dan Anak |
||
b. Remaja dan Dewasa (> 15 tahun)
|
Kategori |
Sistole (mmHg) |
Diastole (mmHg) |
|
Hipotensi |
< 90 |
< 60 |
|
Normal |
90 – 119 |
60 – 79 |
|
Prehipertensi |
120 – 139 |
80 – 89 |
|
Hipertensi derajat 1 |
140 – 159 |
90 – 99 |
|
Hipertensi derajat 2 |
160 – 179 |
100 – 109 |
|
Krisis Hipertensi |
180 atau lebih |
110 atau lebih |
|
Tabel 3: Rentang Nilai Tekanan Darah pada Dewasa |
||
Faktor-Faktor yang Mempengaruhi Tekanan Darah (Perry dan Potter, 1993)
a. Umur
Tekanan darah akan semakin meningkat seiring dengan bertambahnya usia. Hal ini dikaitkan dengan berkurangnya elastisitas pembuluh darah arteri, dinsing arteri semakin kaku sehingga tahanan pada arteri semakin basar dan meningkatkan tekanan darah.
b. Waktu Pengukuran
Tingkat tekanan darah berubah-ubah sepanjang hari. Tekanan darah biasanya rendah pada pagi-pagi sekali, secara berangsur-angsur naik pagi menjelang siang dan sore, dan puncaknya pada senja hari atau malam. Tidak ada orang yang pola dan derajat variasinya sama.
c. Latihan dan Aktivitas Fisik
Latihan dan aktivitas fisik dapat meningkatkan cardiac output dan tekanan darah. Hal ini berkaitan dengan peningkatan metabolism tubuh. Aktivitas fisik membutuhkan energi sehingga membutuhkan aliran yang lebih cepat untuk mensuplai oksigen dan nutrisi (tekanan darah naik).
d. Stress (kecemasan, takut, emosi dan nyeri)
Stress ini akan merangsang syaraf simpatik, mengakibatkan peningkatan denyut jantung serta peningkatan resistensi atau tahanan arteri. Selain itu juga mengakibatkan vasokonstriksi arteri.
e. Miscellaneus Faktor/Posisi Tubuh
Posisi tubuh sangat berpengaruh terhadap tekanan darah. Hal ini berkaitan dengan efek gravitasi bumi. Pada saat berbaring, gaya gravitasi pada peredaran darah lebih rendah karena arah peredaran tersebut horizontal, sehingga jantung tidak terlalu memompa dan tidak terlalu melawan gaya gravitasi. Pada saat duduk maupun berdiri, kerja jantung dalam memompa darah akan lebih keras karena melawan gaya gravitasi bumi, sehingga kecepatan denyut jantung meningkat. Posisi berbaring tekanan darah lebih rendah daripada duduk atau berdiri. Baroresepsor akan merespon saat tekanan darah turun dan berusaha menstabilankan tekanan darah.
f. Obat-obatan
Terdapat beberapa obat yang dapat menyebabkan peningkatan ataupun penurunan tekanan darah, seperti analgetik yang dapat menurunkan tekanan arah.
B. Pemeriksaan Suhu Tubuh
Pemeriksaan suhu tubuh akan memberikan tanda/hasil suhu inti yang secara ketat dikontrol karena dapat dipengaruhi oleh reaksi kimiawi. Pemeriksaan suhu tubuh dapat dilakukan di beberapa tempat, yaitu:
a. Aksila/Ketiak, dilakukan selama 5-10 menit (Eoff dan Joyce, 1981 b. Oral/mulut, dilakukan selama 2 menit (Baker et.al, 1984) c. Rectal/Anus, dilakukan selama 2 menit (Kucha, 1972) d. Timpanik/Telinga, dilakukan selama 2 detik (Erickson et.al,1991)
Nilai standar untuk mengetahui batas normal suhu tubuh manusia dibagi menjadi empat yaitu :
a. Hipotermi, bila suhu tubuh kurang dari 36°C. Untuk mengukur suhu hipotermi diperlukan termometer ukuran rendah (low reading thermometer) yang dapat mengukur sampai 25 derajat Celcius. b. Normal, bila suhu tubuh berkisar antara 36,5 - 37,5°C c. Febris / pireksia / panas, bila suhu tubuh diatas 37,5 - 40°C d. Hipertermi, bila suhu tubuh lebih dari 40°C
Faktor-Faktor yang Mempengaruhi Suhu Tubuh
a. Kecepatan metabolisme basal Kecepatan metabolisme basal tiap individu berbeda-beda. Hal ini memberi dampak jumlah panas yang diproduksi tubuh menjadi berbeda pula. Suhu tubuh sangat terkait dengan laju metabolisme. b. Rangsangan saraf simpatis Rangsangan saraf simpatis dapat menyebabkan kecepatan metabolisme menjadi 100% lebih cepat. Disamping itu, rangsangan saraf simpatis dapat mencegah lemak coklat yang tertimbun dalam jaringan untuk dimetabolisme. Hampir seluruh metabolisme lemak coklat adalah produksi panas. Umumnya, rangsangan saraf simpatis ini dipengaruhi stress individu yang menyebabkan peningkatan produksi epineprin dan norepineprin yang meningkatkan metabolisme. c. Hormone pertumbuhan Hormone pertumbuhan (growth hormone) dapat menyebabkan peningkatan kecepatan metabolisme sebesar 15-20%. Akibatnya, produksi panas tubuh juga meningkat. d. Hormone tiroid Fungsi tiroksin adalah meningkatkan aktivitas hamper semua reaksi kimia dalam tubuh sehingga peningkatan kadar tiroksin dapat memengaruhi laju metabolisme menjadi 50-100% diatas normal. e. Hormone kelamin Hormone kelamin pria (testosterone)dapat meningkatkan kecepatan metabolisme basal kira-kira 10-15% kecepatan normal, menyebabkan peningkatan produksi panas. Pada perempuan, fluktuasi suhu lebih bervariasi dari pada laki-laki karena pengeluaran hormone progesterone pada masa ovulasi meningkatkan suhu tubuh sekitar 0,3 – 0,6°C di atas suhu basal. f. Demam (peradangan) Proses peradangan dan demam dapat menyebabkan peningkatan metabolisme sebesar 120% untuk tiap peningkatan suhu 10°C. g. Status gizi Malnutrisi yang cukup lama dapat menurunkan kecepatan metabolisme 20 – 30%. Hal ini terjadi karena di dalam sel tidak ada zat makanan yang dibutuhkan untuk mengadakan metabolisme. Dengan demikian, orang yang mengalami mal nutrisi mudah mengalami penurunan suhu tubuh (hipotermia). Selain itu, individu dengan lapisan lemak tebal cenderung tidak mudah mengalami hipotermia karena lemak merupakan isolator yang cukup baik, dalam arti lemak menyalurkan panas dengan kecepatan sepertiga kecepatan jaringan yang lain. h. Aktivitas Aktivitas selain merangsang peningkatan laju metabolisme, mengakibatkan gesekan antar komponen otot / organ yang menghasilkan energi termal. Latihan (aktivitas) dapat meningkatkan suhu tubuh hingga 38,3 – 40,0 °C. i. Gangguan organ Kerusakan organ seperti trauma atau keganasan pada hipotalamus, dapat menyebabkan mekanisme regulasi suhu tubuh mengalami gangguan. Berbagai zat pirogen yang dikeluarkan pada saai terjadi infeksi dapat merangsang peningkatan suhu tubuh. Kelainan kulit berupa jumlah kelenjar keringat yang sedikit juga dapat menyebabkan mekanisme pengaturan suhu tubuh terganggu. j. Lingkungan Suhu tubuh dapat mengalami pertukaran dengan lingkungan, artinya panas tubuh dapat hilang atau berkurang akibat lingkungan yang lebih dingin. Begitu juga sebaliknya, lingkungan dapat memengaruhi suhu tubuh manusia. Perpindahan suhu antara manusia dan lingkungan terjadi sebagian besar melalui kulit. Proses kehilangan panas melalui kulit dimungkinkan karena panas diedarkan melalui pembuluh darah dan juga disuplai langsung ke fleksus arteri kecil melalui anastomosis arteriovenosa yang mengandung banyak otot. Kecepatan aliran dalam fleksus arteriovenosa yang cukup tinggi (kadang mencapai 30% total curah jantung) akan menyebabkan konduksi panas dari inti tubuh ke kulit menjadi sangat efisien. Dengan demikian, kulit merupakan radiator panas yang efektif untuk keseimbangan suhu tubuh.
C. Pemeriksaan Frekuensi Nadi
Pemeriksaan denyut nadi merupakan pemeriksaan pada pembuluh nadi atau arteri, dengan cara menghitung kecepatan/loncatan aliran darah yang dapat teraba pada berbagai titik tubuh melalui perabaan. Pemeriksaan nadi dihitung selama satu menit penuh, meliputi frekuensi, keteraturan dan isi. Selain melalui perabaan dapat juga diperiksa melalui stetoskop.
Pemeriksaan denyut nadi bertujuan untuk mengetahui keadaan umum pasien, mengetahui integritas system kardiovaskuler, dan mengikuti perkembangan jalannya penyakit.
Titik denyut, misalnya: denyut arteri temporalis dan arteri frontalis pada kepala, arteri karotis pada leher, arteri brachialis pada lengan atas/siku bagian dalam, arteri radialis dan ulnris pada pergelangan tangan, arteri poplitea pada belakang lutut, dan arteri dorsalis pedis atau arteri tibialis posterior pada kaki.
Frekuensi denyut nadi sangat bervariasi, tergantung jenis kelamin, jenis pekerjaan, dan usia. Demikian juga halnya waktu berdiri, sedang makan, mengeluarkan tenaga atau waktu emosi.
Batasan dan Klasifikasi (Whaley dan Wong, 1993)
Bayi yang baru dilahirkan (1-3 bulan): 120-140 kali/menit, bayi 4 bulan-2 tahun: 80-150 kali/menit, anak 2-10 tahun: 70-110 kali/mnit, anak anak >10 tahun: 55-90 kali/menit, dewasa: 60-90 kali/menit, dan usia lanjut yang sehat: 60/100 kali/menit.
Nadi yang cepat disebut tathicardia atau pulsus frekuens, dan nadi yang lambat disebut bradicardia atau pulsus rarus. Pulsus frekuens dijumpai pada demam tinggi, tirotoksikosis, infeksi streptokokus, difteria dan berbagai jenis penyakit jantung. Nadi yang lambat terdapat pada penyakit miksudema (kekurangan tiroksin), penyakit kuning dan tifoid. Irama nadi sifatnya teratur pada orang sehat, akan tetapi nadi yang tidak teratur belum tentu abnormal. Aritmia sinus adalah gangguan irama nadi, dimana frekuensi nadi menjadi cepat pada saat inspirasi dan melambat waktu ekspirasi. Hal demikian adalah normal dan mudah dijumpai pada anak-anak. Jenis nadi tidak teratur lainnya adalah abnormal.
D. Pemeriksaan Frekuensi Pernafasan
Pemeriksaan frekuensi pernafasan dilakukan dengan menghitung jumlah pernafasan, yaitu inspirasi yang diikuti ekspirasi dalam satu menit penuh. Selain frekuensi, pemeriksa juga menilai kedalaman dan irama gerakan ventilasi (jenis/sifat pernafasan). Selain itu, pemeriksaan ini bertujuan untuk mengetahui keadaan umum klien, mengikuti perkembangan penyakit, dan membantu menegakkan diagnosa.
Jenis Pernafasan
- Chyne Stokes: pernafasan yang sangat dalam yang berangsur-angsur menjadi dangkal dan berhenti sama sekali (apnoe) selama beberapa detik untuk kemudian menjadi dalam lagi. (keracunan obat bius, penyakit jantung, penyakit paru, penyakit ginjal kronis, dan perdarahan pada susunan saraf pusat)
- Biot : pernapasan dalam dan dangkal yang disertai masa apnoe yang tidak teratur. (meningitis)
- Kusmaul : pernapasan yang inspirasi dan ekspirasi sama panjangnya dan sama dalamnya, sehingga keseluruhan pernafasan menjadi lambat dan dalam. (keracunan alkohol dan obat bius, koma, diabetes, uremia
Batasan Normal
Batasan normal beraneka ragam tergantung usia. Pada bayi: 30 – 60 kali/menit, anak-anak: 20 – 30 kali/menit, remaja: 15 – 24 kali/menit, dan dewasa: 16 – 20 kali/menit.
Jenis Ketidaknormalan Bunyi Pernafasan
- Crackel (bunyi nafas seperti retakan/pecahan)
- Friction (bunyi nafas seperti ada tarikan dinding dada ke dalam)
- Grunting (bunyi nafas seperti rintihan)
- Ronchi (bunyi nafas seperti terengah-engah)
- Stridor (bunyi nafas kasar)
- Wheezing (bunyi nafas seperti siulan).
Selengkapnya:
Materi PPT –> Pemeriksaan TTV-Gita K
Daftar Tilik –> Daftar Tilik TTV
Daftar Tilik Pencegahan Infeksi
Daftar Tilik Pencegahan Infeksi:
- Cuci tangan medis
- Cuci tangan bedah
- Menggunakan sarung tangan steril
- Pemrosesan alat
- Disinfeksi Tingkat Tinggi (DTT)
- Sterilisasi
Daftar Tilik –> Daftar Tilik KDK I-PI-Gita K
Pemrosesan Alat-Alat Medis (2) “Tahapan Proses Eradikasi”
Oleh: Gita Kostania
Tabel: Jumlah Mikroorganisme yang dapat Dihilangkan pada Setiap Tahapan Proses Eradikasi
|
Keterangan |
Dekontaminasi |
Pembilasan |
Pencucian |
DTT |
Sterilisasi |
|
Tingkat Eradikasi Mikroorganisme |
Terutama virus pathogen (Hepatitis B dan HIV/AIDS) |
50% |
80% |
95% |
100% |
|
Proses |
Rendam dalam larutan klorin 0,5% |
Siram dengan air |
Pakai sabun larutan antiseptic dan air |
Rebus/ kukus 20 menit |
Panas 1700C & panas 1210 C, uap 106 Kpa 60 menit dan 20-30 menit |
|
Hasil |
Inaktivasi dan membunuh virus pathogen dan beberapa mikroorganisme |
Hilangkan mikroorganisme secara fisik dengan pembersihan |
Pembersihan |
Sisa kuman dengan endospora |
Menghilangkan semua mikroorganisme |
Dekontaminasi
Semua peralatan, termasuk sarung tangan, harus dilakukan dekontaminasi segera setelah digunakan agar aman untuk dikelola dan dicuci. Petunjuk:
1. Proses dekontaminasi menggunakan larutan klorin 0,5%
2. Gunakan sarung tangan (sarung tangan tebal dari bahan karet atau polivinil) untuk mengumpulkan dan memasukkan instrument ke dalam larutan
3. Siapkan wadah khusus dan bahan anti karat (plastic, email atau porselen) dengan ukuran yang memadai bagi sejumlah peralatan instrument
4. Jumlah cairan harus cukup untuk merendam seluruh instrument
5. Rendam selama 10 menit
6. Gunakan larutan yang baru
7. Ganti larutan bila sudah digunakan berulangkali atau menjadi keruh, kondisi larutan yang baik menjamin daya kerja yang efektif
8. Setelah semua instrument direndam, bersihkan sarung tangan di dalam larutan klorin tersebut, lepaskan secara terbalik, kemudian rendam dalam larutan yang sama
9. Cuci tangan dengan sabun/larutan antiseptic, bilas dengan air bersih hingg bersih
10. Permukaan yang luas seperti meja periksa atau meja tindakan yang terkena darah atau cairan tubuh pasien harus dilakukan dekontaminasi dengan jalan menyeka permukaan atau benda-benda yang tercemar dengan klorin 0,5%.
Petunjuk Pembuatan Larutan Klorin
|
Rumus untuk membuat larutan yang diencerkan dari larutan KONSENTRAT/SEDIAAN
Contoh :
Membuat larutan klorin 0,5% dari klorin 5,25%
|
Membuat larutan klorin 0,1 % dari konsentrat 5 %
|
Bila digunakan air matang, larutan klorin 0,1 % cukup baik. Bila dilarutkan dalam air bersih tetapi belum matang atau difiltrasi dibutuhkan konsentrasi 0,5%. Hal ini disebabkan sebagian klorin yang ada diinaktivasi oleh mikroorganisme yang terdapat di dalam air mentah.
|
Rumus untuk membuat larutan yang mengandung klorin dari BUBUK KERING
Contoh:
Membuat larutan yang mengandung klorin 0,5 % dari bubuk kaporit dengan konsentrat 35 %
|
Pencucian
Petunjuk:
1. Pencucian tidak dianjurkan menggunkan air panas karena akan mengkoagulasi protein (termasuk darah) sehingga menyulitkan pembersihkan. Sabun atau detergen sangat membantu membersihkan bagian-bagian yang mengandung lemak dan protein. Tidak diperkenankan menggunakan sabun tangan karena meninggalkan residu yang sulit dibersihkan.
2. Gunakan sarung tangan tebal/rumah tangga jangan yang mudah robek atau sudah bocor. Dianjurkan menggunakan kaca mata pelindung untuk melindungi mukosa mata dari percikan.
3. Buka semua instrument yang mempunyai engsel dari kunci. Lepaskan bagian yang dapat dilepas atau dibongkar pasang. Bersihkan bagian dalam dan luar dari sarung tangan
4. Masukkan instrument dari wadah dekontaminasi ke dalam wadah yang berisi air dan sabun
5. Bersihkan bagian-bagian instrument yang kotor atau dicemari darah/cairan tubuh
6. Lakukan penyikatan di dalam air rendaman untuk mengurangi percikan bahan-bahan yang terlepas akibat penyikatan atau cairan pencuci
7. Untuk membersihkan darah atau jaringan dari ujung kanula : meghisap dan mengeluarkan cairan sabun atau detergen berkali-kali hingga kotoran hilang. Apabila belum bersih, pegang dan masukkan kanula ke dalam air kocok maju mundur kuat-kuat (hati-hati jangan sampai terkena percikan). Jangan menggunakan sikat untuk membersihkan kotoran dalam kanula karena akan menggores dinding dalam kanula dan menjadi tempat berlindung mikroorganisme
8. Sikat dan seka hingga jelas tampak bersih
9. Bilas dengan air mengalir agar bersih dari sisa bahan/kotoran dan cairan pencuci/busa sabun, karena beberapa detergen dapat menghambat kerja desinfektan kimiawi
10. Letakkan instrument di atas kain bersih, instrument yang akan diproses lebih lanjut (DTT) dengan jalan perebusan, dapat langsung dimasukkan ke dalam panic perebus.
Desinfeksi Tingkat Tinggi ( DTT )
Panas Basah ( Perebusan atau Pengukusan ), petunjuk :
1. Proses dilakukan setelah dekontaminasi dan pencucian
2. Gunakan wadah dari bahan logam dan mempunyai penutup
3. Instrument harus terendam seluruhnya di dalam air (rebus) atau tidak melebihi tingkat wadah pengukusan (kukus)
4. Usahakan agar jumlah instrument tidak terlalu banyak/penuh agar pengurangan air akibat penguapan, tidak menyebabkan sebagian instrument berada di atas permukaan air atau instrument memukul dinding wadah/membuka tutup pada saat air bergolak (rebus)
5. Waktu 20 menit dihitung dari saat air mulai mendidih atau terbentuknya uap yang diakibatkan oleh air yang mendidih. Tidak diperkenankan menambah air atau apapun apabila proses perebusan atau pengukusan belum selesai. Ingat : uap air panas pada 800 C, membunuh semua bakteri, virus, parasit, dan jamur dalam 20 menit. Kecuali bila ketinggian klinik di atas 5500 meter tidak perlu memperpanjang waktu perebusan
6. Sesudah 20 menit, matikan api/pemutus arus listrik, pindahkan wadah dan atau buka penutupnya, keluarkan instrument (pakai penjepit), dinginkan, langsung pakai atau simpan di wadah DTT.
Kimiawi, petunjuk:
1. Sebelumnya instrument harus sudah melalui proses dekontaminasi dan pencucian
2. Gunakan larutan: klorin 0,1 – 0,5 % (tergantung air pelarut); Glutaraldehida 2 % atau sesuai dengan petunjuk penggunaan
3. Meskipun alcohol, iodine & iodophor relative murah, tidak diklasifikasikan untuk DTT
4. Larutan klorin sangat efektif melawan virus Hepatitis B dan AIDS, murah dan mudah diperoleh. Klorin sangat berguna untuk dekontaminasi permukaan yang luas (meja periksa). Klorin besifat korosif terhadap benda logam, namun instrument tahan karat cukup aman untuk direndam (menggunakan wadah plastic) 20 menit. Klorin cepat sekali berubah keadaannya sehingga harus dibuat larutan baru atau harus selalu diganti. WHO (1989) menganjurkan proses dekontaminasi dengan klorin 0,5 %, sedangkan DTT klorin 0,1 %, dianggap cukup efektif dan pelarutnya dengan air matang. Glutaraldehida dipakai sebagai sterilisator kimiawi dan DTT. Zat ini kurang iritatifnya dibanding formaldehida. Larutan atau tablet formaldehida untuk proses pencegahan infeksi harus dihindari karena bersifat karsinogen.
5. Sebaiknya digunakan larutan yang baru dicampur atau masa penggunaannya belum kadaluarsa
6. Gunakan wadah yang mempunyai penutup dan terbuat dari bahan non korosif (plastic, kaca, email atau alumunium)
7. Digunakan untuk instrument yang tidak tahan panas (plastic, lensa optic dan karet)
8. Instrument harus terendam dengan baik
9. Waktu untuk DTT adalah 20 menit
10. Setelah 20 menit, angkat instrument (pakai penjepit), bilas dengan air DTT/steril hingga sisa larutan DTT dapat dihilangkan (karena iritatif) langsung digunakan atau disimpan di dalam wadah DTT dapat disimpan hingga 1 minggu.
Sterilisasi
Otoklaf ( Sterilisasi Uap ), petunjuk :
1. Instrument harus sudah diproses dekontaminasi dan pencucian sebelum sterilisasi
2. Instrument sudah dibungkus (apabila diperlukan) dan disusun sedemikian rupa sehingga panas dan uap bertekanan, dapat mencapai semua bagian secara efektif. Periksa persiapan otoklaf ( listrik, jumlah air, alat penera suhu dan tekanan, kunci penutup )
3. Setelah penyusunan selesai, tutup penutupnya dan lakukan penguncian, hidupkan arus listrik atau pemanas, atur suhu hingga 1210 C (2500 F) dan tekanan 106 Kpa
4. Setelah kondisi tersebut tercapai, mulai dilakukan penghitungan atau pengaturan waktu 20 menit ( untuk instrument yang tidak dibungkus ) dan 30 menit ( untuk instrument terbungkus )
5. Matikan arus listrik atau sumber pemanas, keluarkan sisa tekanan dan uap air, keluarkan instrument yang diinginkan. Diamkan semua alat sampai kering sebelum diangkat. Setelah dingin, instrument siap dipergunakan, apabila tidak langsung dipakai, simpan di tempat/tromol kecil.
Oven ( Sterilisasi Panas Kering ), petunjuk :
1. Sebelum dilakukan proses ini, instrument sudah melalui proses dekontaminasi dan pencucian
2. Susun sedemikian rupa sehingga paparan panas mencapai seluruh permukaan instrument secara efektif. Jangan mengisi terlalu penuh, karena akan mempengaruhi penyaluran panas dan menambah waktu yang diperlukan
3. Tutup oven, atur temperature pada suhu 1700 C
4. Setelah mencapai temperature tersebut, mulai dilakukan pengaturan atau perhitungan waktu untuk 60 menit ke depan
5. Untuk alat-alat tajam ( gunting, jarum ), sterilisasi dilakukan dengan suhu 1600 C, selama 2 jam tidak lebih dari 162,80 C (3250 F), bila tidak bagian tajam akan rusak
6. Waktu dihitung sejak oven mencapai suhu yang diinginkan
7. Matikan arus listrik atau sumber pemanas setelah proses selesai, buka penutup oven, ambil instrument ( pakai penjepit ), dinginkan, langsung pakai/simpan di tempat steril
8. Alat yang sudah streril sebaiknya segera digunakan atau dibungkus 2 lapis dengan kain kassa, kertas atau lainnya sebelum disterilkan. Pembungkus harus cukup berpori sehingga uap dapat masuk, namun juga cukup rapat untuk melindungi agar partikel debu atau mikroorganisme lainnya tidak dapat masuk. Alat-alat steril yang dibungkus dapat disimpan lebih dari 1 minggu asal tetap kering dan pembungkusnya utuh (Perkins, 1983). Penyimpanan dalam plastic yang disegel dapat bertahan 1 bulan. Seluruh bungkusan diberi label dan batas kedaluarsa.
Sterilisasi Kimiawi / Sterilisasi Dingin, petunjuk:
1. Sebelum proses ini, instrument sudah melalui proses dekontaminasi dan pencucian
2. Gunakan larutan : Glutaraldehida (Cydex) 2 % atau sesuai petunjuk penggunaan
3. Pakai larutan yang baru dicampur atau belum kedaluwarsa
4. Gunakan wadah non korosif dan mempunyai penutup
5. Pastikan instrument terendam secara baik
6. Waktu sterilisasi : direndam 8 – 10 jam (Glutaraldehida 2 %), 24 jam (Formaldehida 8 %). Glutaraldehida membutuhkan tambahan penanganan khusus karena meninggalkan endapan pada alat-alat yang disterilkan, sehingga setelah digunakan harus dibilas bersih.
7. Apabila instrument ini ingin segera dipakai, setelah waktu tersebut tercapai, angkat instrument (pakai penjepit), hilangkan sisa larutan tersebut dengan air steril (pembilasan) den letakkan di tempat steril
8. Instrument dapat tetap disimpan dalam wadah yang berisi larutan tersebut tetapi larutan ini harus diganti setiap 2 minggu. Apabila instrument ingin digunakan, tetap harus dilakukan pembilasan dengan air steril
9. Pembilasan ini sangat penting karena larutan yang digunakan dalam proses ini bersifat iritatif terhadap mukosa dan jaringan tubuh.
Pemrosesan Alat-Alat Medis (1)
Oleh: Gita Kostania
Proses pertama pada peralatan/instrument yang telah digunakan adalah dekontaminasi. Dekontaminasi dilakukan untuk mengamankan instrument dari bahan-bahan yang mungkin mengandung mikroorganisme yang membahayakan kesehatan. Proses ini dilakukan dengan merendam instrument dalam larutan klorin 0,5%. Setelah ini instrument baru dianggap aman untuk disentuh. Petugas yang melaksanakan harus memakai sarung tangan tebal/rumah tangga (sebagai pengaman ganda). Proses selanjutnya adalah pencucian, dimana instrument dibersihkan dengan sabun, sikat dan air hingga bersih (termasuk bagian engsel, bergigi atau permukaan kasar). Kemudian instrument dikeringkan dengan kain bersih, disusun dan diseleksi ulang. Sebelum dimasukkan ke dalam wadah untuk proses sterilisasi dilakukan pembungkusan untuk instrument tertentu, sedangkan instrument lain dibiarkan terbuka.
Instrumen yang diproses dengan DTT (direbus), umumnya tidak dilakukan pembungkusan, hanya dilakukan pembungkusan dengan kain apabila prosesnya dilakukan dengan uap air panas (pengukusan). Setelah semua proses selesai, letakkan instrument pada tempat yang telah disediakan (steril dan DTT) dan biarkan hingga dingin. Ambil dan susun kembali pada tempat penyimpanan instrument (bila tidak segera dipkai) atau dapat segera digunakan apabila memang diperlukan.
Apabila terjadi kebocoran tempat instrument, tutup penyimpanan terbuka atau terjadi gangguan saat terjadi proses cuci hama (aliran listrik putus, uap air kurang, volume air kurang mencukupi atau tertumpah, dll) maka proses sterilisasi dan DTT harus diulang dari awal.
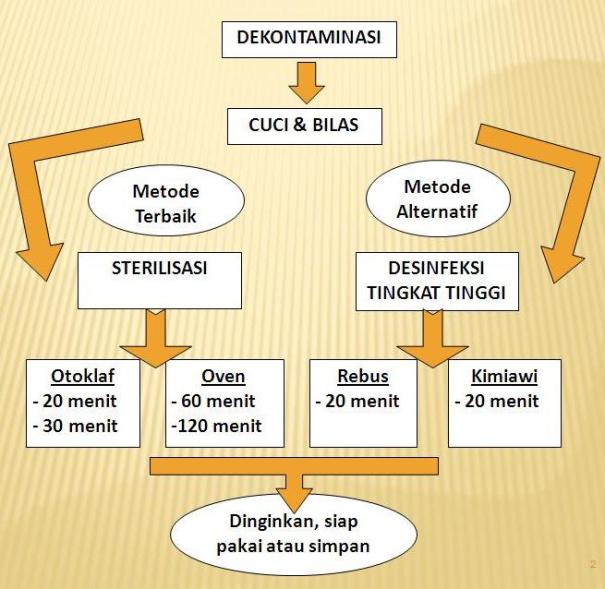
Gambar Skema Prosedur Pemrosesan Alat
Kerangka Gambar Posedur Pemrosesan Alat:
– Otoklaf tanpa terbungkus 20 menit, terbungkus 30 menit. 106 Kpa 1210 C (2500 F)
– Oven 1700 C (3400 F) selama 60 menit, 1600 C (3200 F) selama 120 menit
– Instrumen yang terbungkus dalam keadaan steril dapat disimpan dalam wadah steril atau DTT dengan tutup rapat selama 2 minggu, atau segera dipakai.
Cuci Tangan
Oleh: Gita Kostania
Pada bahasan ini, difokuskan pada prinsip-prinsip cuci tangan, cara yang penting tentang pengendalian infeksi. Dalam istilah promosi kesehatan yang positif, cuci tangan menjadi satu-satnya prosedur klinis paling utama : tangan adalah jalur terpenting terjadinya infeksi silang ( cross-infection ). Mencuci tangan dengan sabun dan air memindahkan hamper semua bakteri sementara (transient) tetapi tidak mengurangi banyaknya bakteri yang tinggal (resident) : Staphilococcus aureus, dengan beberapa jumlah yang signifikan.
Cuci tangan adalah proses dengan semua permukaan tangan digosok bersama-sama dengan penuh tenaga (vigourously) menggunakan satu agen pembersih yang sesuai dan dibilas di bawah air mengalir dengan tujuan memindahkan sejumlah mikroorganisme yang mungkin. Ada dua prosedur yang dapat diikuti : medical scrub dan surgical scrub. Cuci tangan medis/biasa digunakan untuk teknik aseptic, dan cuci tangan bedah digunakan saat penyikatan pada prosedur operasi dan merupakan prosedur yang lama dengan menyertakan tangan dan lengan.
Perawatan Tangan Umum
1. Memeriksa tangan : terpotong, luka goresan, kutikula. Hal tersebut menngkatkan risiko dari infeksi bagi tenaga medis, dan harus ditutup dengan plester
2. Memelihara kuku yang pendek dan terkikir. Kuku yang panjang atau kasar dapat menggaruk pasien wanita dan bayi, serta mengantarkan infeksi, kotoran dan pengeluaran (secret), yang mungkin ditemukan di bawah kuku sebagai tempat persembunyian mikroorganisme
3. Menggunakan pelembab tangan secara teratur mencegah kering dan pecah.
Indikasi untuk Cuci Tangan
1. Sebelum dan setelah kontak dengan kulit pasien wanita atau bayi atau cairan tubuh
2. Sebelum melakukan teknik aseptic
3. Sebelum memegang makanan
4. Saat terlihat menjadi kotor
5. Setelah keluar dari kamar kecil
6. Setelah kontak dengan alat-alat yang kotor dan berpotensi tercemar/terkontaminasi
7. Setelah melepas sarung tangan
Prinsip Cuci Tangan
1. Mempertimbangkan semua peralatan sebagai hal yang tercemar: minimal tentang memegang kran, mengeluarkan sabun, sinks, mengeringkan alat-alat, terutama setelah mencuci, dengan menggunakan pedal bins, disarankan menyikut kran.
2. Menghindari memakai perhiasan. Cincin meningkatkan banyaknya mikroorganisme yang ditemukan di tangan. Perhiasan mempersulit membersihkan tangan secara menyeluruh.
3. Menggunakan air mengalir, dan mengatur aliran untuk kenyamanan. Menghindari percikan air, terutama di atas pakaian, mikroorganisme mungkin ditransfer dan berkembangbiak di dalam uap lembab.
4. Menggunakan sabun yang sesuai dan berbusa. Sabun akan mengemulsi lemak dan minyak, serta menurunkan ketegangan permukaan, membuat lebih mudah dibersihkan.
5. Menggunakan gerakan yang melingkar, menganjurkan menggosok dan menggesek. Hal ini melepas dan memindahkan kotoran dan mikroorganisme sementara (transient).
6. Menggunakan handuk kertas disposibel untuk mengeringkan tangan. Hal ini meminimalkan penyebaran mikroorganisme dibandingkan dengan pengering udara panas dan handuk.
Peran dan Tanggung Jawab Bidan
1. Mengenali kapan harus cuci tangan
2. Mampu melakukan medical atau surgery scrub dengan tepat.
Prosedur Cuci Tangan Biasa / Medical Scrub
Untuk cuci tangan yang berlaku di masyarakat/rumah tangga, pada umumnya cukup menggunakan sabun, tangan dicuci minimal 30 detik. Untuk cuci tangan aseptic, cairan antiseptic yang digunakan : 4% clorhexidine solution, dengan mencuci sedikinya 1 menit.
1. Siapkan peralatan yang dibutuhkan
2. Lepas perhiasan yang menempel di jari dan tangan
3. Basahi kedua tangan dengan menggunakan air mengalir, gunakan sabun secara merata pada kedua tangan
4. Gosok kedua tangan dan jari
5. Gosok punggung tangan secara bergantian
6. Gosok sela jari dengan jari-jari tangan yang berlawanan, lakukan secara bergantian
7. Gosok punggung jari secara bergantian
8. Gosok ibu jari secara bergantian
9. Gosok ujung jari pada telapak tangan secara bergantian
10. Genggam pergelangan tangan dengan menggosok-gosok di sekitar pergelangan tangan secara bergantian
11. Bilas kedua tangan dengan air bersih yang mengalir
12. Matikan kran dengan menggunakan siku
13. Keringkan tangan dengan handuk bersih atau tisyu.
Prosedur Cuci Tangan Bedah / Surgical Scrub
1. Siapkan peralatan dan bahan yang dibutuhkan
2. Lepas perhiasan yang menempel di jari dan tangan
3. Basahi kedua tangan dengan menggunakan air mengalir sampai siku, gunakan sabun kea rah lengan bawah, lakukan hal yang sama pada tangan yang lain
4. Bersihkan kuku dengan pembersih kuku atau sikat lembut kea rah luar, kemudian bersihkan jari hingga siku dengan gerakan sirkuler dengan spon. Mengulangi hal yang sama pada lengan yang lain. Lakukan minimal selama 2 menit.
5. Membilas tangan dan lengan secara terpisah dengan air mengalir, setelah bersih tahan kedua tangan mengarah ke atas sebatas siku, jangn biarkan air bilasan mengalir ke area bersih
6. Menggosok seluruh permukaan kedua belah tangan, jari dan lengan bawah dengan antiseptic minimal selama 2 menit
7. Membilas setiap tangan dan lengan secara terpisah dengan air mengalir, setelah bersih tahan kedua tangan mengarah ke atas sebatas siku, jangan biarkan air bilasan mengalir ke area bilasan
8. Menegakkan kedua tangan ke arah atas dan jauhkan dari badan, jangan sentuh permukaan atau benda apapun
9. Mengeringkan tangan menggunakan handuk steril atau diangin-anginkan , seka tangan dimulai dari ujung jari hingga siku. Untuk tangan yang berbeda gunakan sisi handuk yang berbeda.
Prinsip Pencegahan Infeksi
Oleh: Gita Kostania
Pencegahan infeksi sering diartikan dalam pengertian sempit sebagai: tindakan suci hama/pemutusan rantai transmisi penyakit. Tujuan pencegahan infeksi pada pelayanan kesehatan:
1. Mencegah terjadinya komplikasi infeksi pasca tindakan (terutama untuk tindakan atau prosedur klinik menggunakan instrumen)
2. Menghindari terjadinya penularan penyakit infeksi berbahaya (HIV, Hepatitis B), bukan hanya pasien ke pasien, tetapi juga dari pasien ke petugas kesehatan atau sebaliknya.
Dalam menjalankan upaya kewaspadaan standar, dianjurkan memperhatikan prinsip-prinsip, sbb:
1. Setiap individu (pasien dan petugas kesehatan) dianggap berpotensi menularkan penyakit
2. Cuci tangan adalah prosedur praktis dlam menghindari kontaminasi silang. Cuci tangan dilakukan: sebelum dan sesudah memeriksa pasien; sebelum dan setelah memakai sarung tangan; setelah terpapar darah atau cairan tubuh lainnya; cuci tangan selama 10-15 detik dengan sabun dan air mengalir; sebagai pengganti cuci tangan dengan air, gunakan larutan alcohol (100ml alcohol 60-90% + 2ml gliserin)
3. Gunakan sarung tangan setiap akan terjadi kontak dengan bagian atau bahan berpotensi menularkan penyakit (laserasi kulit, membrane mukosa, darah, secret, cairan tubuh lain). Sarung tangan digunakan: saat melakukan tindakan; saat menangani alat/bahan terkontaminasi; saat membuang bahan-bahan/limbah terkontaminasi. Ganti sarung tangan setiap kali memeriksa pasien yang berbeda. Sarung tangan dapat digunakan kembali apabila telah didekontaminasi dalam larutan klorin 0,5%, kemudian dicuci dan dibilas, selanjutnya disterilisasi atau di-DTT.
4. Gunakan pelindung fisik (kaca mata pelindung, masker, apron atau pelepas plastic) untuk menghindari percikan secret atau cairan tubuh
5. Gunakan bahan antiseptic untuk membersihkan kulit atau membrane mukosa sebelum melakukan operasi, membersihkan luka, atau menggosok tangan sebelum operasi dengan bahan antiseptic berbahan dasar alcohol
6. Buang bahan-bahan terinfeksi setelah terpakai dengan aman untuk melindungi petugas pembuangan dan mencegah cidera maupun penularan infeksi kepada orang lain/masyarakat
7. Bekerja hati-hati (perhatikan factor keamanan). Gunakan langkah dan teknik yang baik serta aman saat menggunakan dan menangani benda tajam (jarum suntik, pisau bedah)
Mencegah luka tusuk jarum di kamar operasi : gunakan wadah yang aman; jangan memberikan alat tajam selain menggunakan wadah yang aman; beritahu petugas kesehatan sebelum memberikan alat-alat tajam dalam wadah yang aman.
Menggunakan jarum dan alat suntik yang benar : gunakan jarum dan suntik sekali pakai; jangan melepaskan jarum dari alat suntik setelah digunakan; jangan memasang tutup jarum, membengkokkan atau mematahkan jarum sebelum dibuang; lakukan dekontaminasi terhadap jarum dan alat suntik sebelum dibuang (yang disposibel) atau sebelum diproses (dipakai ulang); buang jarum dan alat suntik ke dalam wadah tahan tusuk; hancurkan jarum dan alat suntik dengan dibakar (incenerated).
8. Keterbatasan sumber daya bukan merupakan alas an bagi petugas untuk merubah prosedur atau bahan-bahan yang dipergunakan untuk pencegahan infeksi karena masih banyak proses alternative yang memenuhi kaidah ilmiah dan terbukti cukup efektif.
Tabel Upaya Kewaspadaan Standar
|
Mencuci tangan |
Setelah menyentuh darah, cairan tubuh, sekresi dan benda terkontaminasi; segera setelah melepas sarung tangan; sebelum dan setelah memeriksa pasien satu ke pasien lain |
|
Sarung tangan |
Untuk kontak: darah, cairan tubuh, sekresi, bahan terkontaminasi; untuk kontak: membrane mukosa dan kulit tidak utuh (koyak,terkelupas) |
|
Masker, kaca mata, pelindung wajah |
Melindungi membrane mukosa mata, hidung dan mulut ketika terjadi kontak dengan darah dan cairan tubuh |
|
Gaun operasi |
Melindungi kulit dari percikan darah dan cairan tubuh lain; mencegah agar pakaian tidak terkontaminasi darah mupun cairan tubuh selama melakukan tindakan |
|
Kain linen |
Tangani linen yang telah terkontaminasi sedemikian rupa agar tidak menyentuh kulit atau membrane mukosa; jangan melakukan pembilasan awal untuk kain linen yang telah terkontaminasi |
|
Peralatan perawatan pasien |
Tangani alat yang telah terkontaminasi sedemikian rupa sehingga tidak menyentuh kulit atau membrane mukosa dan untuk mencegah agar baju maupun lingkungan tidak terkontaminasi; bersihkan peralatan pakai ulang sebelum digunakan kembali |
|
Membersihkan lingkungan |
Perawatan rutin, membersihkan dan desinfeksi perlengkapan dan perabotan di ruang asuhan pasien |
|
Benda-benda tajam |
Jangan memasang kembali tutup jarum suntik yang telah digunakan; jangan melepas jarum dari alat suntik/semprit sekali pakai; jangan membengkokkan dan mematahkan jarum bekas pakai dengan tangan; letakkan benda tajam yang telah digunakan ke dalam wadah anti tusukan |
|
Resusitasi pasien |
Gunakan pelindung mulut, kantung resusitasi atau alat pernapasan lainnya untuk menghindari pemberian resusitasi dari mulut ke mulut |
|
Penempatan pasien |
Tempatkan pasien yang dapat mengkontaminasi lingkungan maupun yang tidak terjamin kebersihannya pada ruang khusus/terpisah |
Istilah dalam Proses Pencegahan Infeksi
1. Mikroorganisme: jasad renik yang dapat menyebabkan infeksi (bakteri, virus, jamur dan parasit)
2. Tindakan asepsis: upaya-upaya untuk menghilangkan/mengurangi jumlah mikroorganisme (permukaan/benda/instrument) hingga tingkat aman bagi kesehatan manusia agar dapat mencegah terjadinya infeksi/penyakit akibat masuknya mikroorganisme ke dalam tubuh
3. Tindakan antiseptic: upaya-upaya untuk mencegah terjadinya infeksi dengan jalan membunuh atau menghambat pertumbuhan mikroorganisme pada permukaan atau jaringan tubuh
4. Dekontaminasi: upaya untuk menghilangkan dekontaminan/cemaran pada instrument atau peralatan medic
5. Penyucian: proses fisik untuk menghilangkan darah, cairan tubuh atau bahan-bahan lain yang mencemari instrument atau permukaan tubuh/kulit
6. Disinfeksi Tingkat Tinggi (DTT): proses dilakukan untuk menghilangkan hampir semua mikroorganisme (kecuali mikroorganisme dengan endospora)
7. Sterilisasi: proses yang dilakukan untuk menghilangkan semua mikroorganisme, termasuk organism dengan endospora.
Penggunaan istilah asepsis bila yang ingin dijelaskan adalah proses yang dilakukan pada peralatan atau instrument (benda mati), sedangkan istilah antiseptis pada permukaan atau jaringan tubuh (benda hidup).
Desinfeksi dan Desinfeksi Tingkat Tinggi keduanya upaya yang dilakukan sama yaitu menghilangkan sebagian besar mikroorganisme dari peralatan/instrument namun tingkatannya berbeda. Pada DTT mikroorganisme yang tertinggal hanya dari golongan yang mempunyai endospora, sedangkan desinfeksi maka jaminan kondisi seperti ini, tidak dapat diberikan.
Barier Protektif
Membuat barier atau halangan fisik, mekanik atau kimiawi di antara antara mikroorganisme dan individu, merupakan upaya efektif untuk mencegah transmisi penyakit. Transmisi dapat terjadi di antara satu individu dengan individu yang lain : instrument, perlengkapan dan permukaan atau benda-benda di sekitar tempat kerja dengan manusia.
Barier protektif dalam mencegah infeksi adalah:
1. Cuci tangan
2. Menggunakan sarung tangan
3. Penggunaan larutan antiseptic
4. Menggunakan pelindung (masker, kaca mata, apron) untuk mencegah terkena percikan darah atau cairan tubuh lainnya
5. Dekontaminasi, cuci dan bilas, DTT atau sterilisasi
6. Menggunakan kain penutup, alas bokong dan pengatur alur cairan darah atau secret selama tindakan.
Cuci Tangan
Selain instrument petugas kesehatan atau operator harus melakukan pencucian, yaitu cuci tangan. Cuci tangan sebelum dan segera sesudah melepas sarung tangan atau sebelum dan sesudah prosedur pemeriksaan. Cuci tangan dengan sabun selama 15 – 30 detik, kemudian bilas di bawah air mengalir.
Karena mikroorganisme cepat tumbuh pada daerah lembab dan air yang tergenang atau air tampungan, maka:
1. Apabila menggunakan sabun batangan, pakai batangan kecil dan letakkan di tempat yang mempunyai lubang untuk mengalirkan sisa air
2. Walaupun air dalam wadah cuci tangan dicampur dengan larutan antiseptic, jangan merendam tangan berulang-ulang dalam air tersebut
3. Bila sulit mendapatkan air mengalir : gunakan air dari wadah yang mempunyai kran atau siram dengan menggunakan gayung, gunakan alcohol pembilas
4. Keringkan tangan dengan handuk kering atau udara panas. Jangan menggunakan handuk bersama orang atau petugas lain
5. Sediakan penampung air cucian dan buang air pada tempat yang ter isolasi/aman.
Sarung Tangan
Gunakan sarung tangan klinis sebelum petugas kesehatan melakukan pemeriksaan atau tindakan. Untuk mengumpulkan dan mencuci instrument, dianjurkan menggunakan sarung tangan rumah tangga.
Teknik tanpa Sentuh
Pada beberapa prosedur invasive dapat terjadi invasi mikroorganisme pathogen bersamaan dengan tindakan. Untuk mengurangi risiko, gunakan teknik tanpa sentuh : melakukan prosedur invasive tanpa menyentuh instrument atau peralatan dengan bagian yang terkontaminasi atau kurang aman ( misal : pemasangan sonde, upayakan ujung sonde langsung masuk pada ostium serviks tanpa menyentuh perineum atau dinding vagina ). Instrument yang telah dimasukkan ke dalam vagina jangan didekatkan dengan instrument yang belum terkontaminasi ( steril ), karena secara tidak sengaja dapat terjadi kontaminasi antara berbagai instrument yang diletakkan pada satu meja instrument. Untuk mencegah hal tersebut, siapkan wadah khusus bagi instrument yang telah dipakai tetapi akan dipakai ulang. Sebelum memasukkan instrument tidak boleh terjadi kontak antara instrument dengan bagian-bagian yang tidak aman (bagian meja yang tidak aman, pakaian, meja ginekologi, sarung tangan bekas pakai, wadah instrument, dll).
Bahan-Bahan yang Tidak Boleh Digunakan sebagai Disinfektan
Antiseptik yang tidak dapat digunakan sebagai disinfektan:
1. Derivate akridin ( Gentian violet atau Kristal violet )
2. Benzalkonium klorid ( Zephiran )
3. Cetrimid ( Cetavlon )
4. Setrimid dengan atau tanpa Klorheksidin glukonat ( Savlon )
5. Clorinated lime dan asam borat ( Eusol )
6. Klorheksidin glukonat ( Phisohek )
7. Klorheksinol ( Dettol )
8. Komponen merkuri ( penggunaannya sangat tidak dianjurkan )
Menyimpan dan Merakit Ulang
Peralatan Steril
Instrumen yang sudah disterilisasi harus diberi tanda atau catatan tentang kapan proses dilakukan dan harus digunakan dalam waktu 7 hari setelah proses. Bila melewati waktu tersebut, instrument harus dicuci dan disterilkan kembali. Tempat penyimpanan instrument tidak boleh diletakkan di lantai dan harus ditempatkan pada tempat yang aman (lemari khusus) yang tidak dapat dimasuki debu, serangga atau terkena genangan air.
Peralatan yang Diproses dengan DTT
Harus disimpan dalam wadah DTT yang kering dan mempunyai sekat atau tutup kuat untuk mencegah kontaminasi. Jangan merendam kanula secara terus-menerus dalam larutan disinfektan atau antiseptic karena dapat terjadi kontaminasi ulangan. Pada saat mengambil kanula dengan cunam atau klem DTT atau steril, upayakan untuk tidak membuat kontaminasi pada instrument lain dalam tempat penyimpanan. Jepit kanula pada pangkalnya sehingga dapat mengurangi kemungkinan kontaminasi pada bagian ujungnya.
Materi PPT –> Prinsip PI-2013
Penanganan Sampah
Pengolahan limbah (terinfeksi atau tidak, basah atau kering, tajam atau tidak), baru dilakukan pengolahan yang sesuai (insenerator, ditanam, tangki septic, dll).
Tujuan , pembuangan sampah klinik adalah:
1. Mencegah penyebaran infeksi ke petugas pengelola limbah/masyarakat
2. Melindungi pengelola limbah dari cedera yang tidak disengaja
3. Menciptakan citra bersih lingkungan
Hal yang Perlu Diperhatikan
Limbah atau sampah jangan dibiarkan terbuka, karena:
1. Meningkatkan risiko infeksi dan bahaya kebakaran
2. Menyebarkan bau busuk
3. Tempat perkembangbiakan serangga
4. Menimbulkan pemandangan yang tidak sehat
Penanganan Tempat Sampah , Petunjuk :
1. Gunakan tempat tahan karat, mudah dibersihkan dan bertutup
2. Letakkan tempat sampah di tempat yang mudah dijangkau
3. Gunakan peralatan khusus pembawa dan tempat sampah
4. Bersihkan kembali semua tempat sampah yang telah digunakan, kemudian bilas dengan larutan desinfektan/dekontaminasi
5. Pisahkan jenis sampah menurut :
a. Sampah yang dapat dibakar : kertas, karton, sampah terkontaminasi seperti kassa dan pembalut bekas pakai
b. Sampah yang tidak dapat dibakar: kaca, logam, dan plastic tahan api
6. Pakailah sarung tangan
7. Cuci tangan setelah menangani sampah
Cara Membuang Benda Tajam
Jarum, pisau cukur, pisau bedah, harus dibuang dengan cara berikut :
1. Gunakan sarung tangan rumah tangga yang tebal
2. Buang barang-barang tajam tadi ke dalam wadah yang tahan tusukan. Wadah dapat dibuat dari bahan-bahan yang mudah didapat, seperti kotak karton tebal, kaleng yang bertutup, atau botol plastic yang tebal. Botol bekas cairan intra vena dapat pula dipakai untuk benda-benda tajam, tetapi ada kemungkinan terjadi kebocoran. Ingat :
a. Letakkan wadah-wadah di dekat tempat pembuangan
b. Cegah terjadinya tusukan jarum yang tidak disengaja, jangan membengkokkan atau mematahkan jarum sebelum dibuang. Jarum tidak perlu ditutup secara rutin, tetapi bila perlu gunakan metode menutup jarum dengan satu tangan :
1) Letakkan penutup jarum pada permukaan yang keras dan rata, kemudian lepaskan tangan dari penutup jarum
2) Dengan satu tangan, pegang tabung alat suntik dan gunakan jarumnya untuk mengait penutup jarum
3) Bela penutup telah mencakup seluruh jarum, gunakan tangan lainnya untuk mengeratkan penutup tersebut pada pangkal jarum.
3. Bila wadah sampah barang tajam tersebut telah terisi ¾ penuh, tutuplah, sumbat atau beri pita perekat rapat
4. Buanglah wadah tersebut bila telah ¾ penuh dengan jalan menguburkannya
5. Cuci tangan setelah menangani benda tajam tersebut dan lakukan dekontaminasi.
Cara Membuang Limbah Cair yang Terkontaminasi(oleh darah, faeces, urine, dan cairan tubuh lain)
1. Gunakan sarung tangan tebal ketika menangani dan membawa limbah cair
2. Hati-hati waktu menuangkan limbah cair tersebut ke dalam saluran pembuangan atau dalam jamban (toilet) bilas, hindari percikan limbah
3. Cuci jamban dan bak secara hati-hati dan siram dengan air untuk membersihkan sisa-sisa limbah cair berbahaya tersebut
4. Dekontaminasi tempat limbah dengan larutan klorin 0,5%, rendam selama 10 menit sebelum dicuci
5. Cuci tangan sesudah menangani sampah cair dan lakukan dekontaminasi, serta cuci sarung tangan.
Cara Membuang Limbah Padat
1. Gunakan sarung tangan tebal ketika menangani dan membawa limbah
2. Buang limbah padat ke dalam wadah yang dapat dicuci, tahan karat dan bertutup
3. Kumpulkan tempat limbah di tempat yang telah ditentukan. Sampah yang akan dibakar dibawa ke insenerator, yang tidak dibakar amankan dengan jalan ditanam
4. Dekontaminasi tempat limbah dengan larutan klorin 0,5% selama 10 menit
5. Bakar atau kubur segera limbah, sebelum berserakan ke lingkungan sekitar.
Cara Membuang Wadah Bekas Bahan Kimia
1. Cuci hingga bersih wadah dari kaca dengan air. Wadah dari kaca dapat dicuci dengan detergen, dibilas dan dipakai kembali.
2. Untuk wadah dari plastic yang berisi bahan toksik, cuci 3 kali dengan air kemudian bahan buangan ditimbun. Wadah bekas ini tidak boleh digunakan untuk keperluan lain.
Cara Membuat Drum Tempat Membakar Sampah Sederhana
1. Cari daerah yang searah dengan angin di sekitar klinik
2. Buat tempat sampah menggunakan bahan local (lumpur atau batu), atau drum minyak bekas. Ukurannya tergantung dengan jumlah sampah yang terkumpul setiap hari.
3. Letakkan tempat pembakaran tersebut di tanah yang keras atau tanah dengan dasar yang kuar
4. Pastikan lokasi pembakaran sampah memiliki :
a. Cukup udara agar pembakaran dapat berjalan dengan baik
b. Batasi tempat pembakaran agar tidak menyebar
c. Mudah dibuka agar dapat menambah sampah baru dan membuang debunya
d. Mempunyai cerobong asap yang cukup panjang untuk memungkinkan aliran udara yang baik dan membuang asap
5. Bakar semua sampah yang dapat dibakar (kertas, karton, pembalut yang sudah digunakan, dll)
6. Untuk sampah kering, tambahkan minyak tanah agr api dapat membakar seluruh sampah
7. Debu yang berasal dari tempat pembakaran, dianggap sebagai limbah yang aman.
Cara Membuat dan Menggunakan Tempat Penimbunan Sampah
1. Kuburkan di lokasi khusus, paling sedikit 50 meter dari sumber air, untuk mencegah kontaminasi : harus memilki tempat pengairan yang baik, sebaiknya terletak di bawah garis air sumur dan bebas genangan air, jangan terletak di tempat yang sering banjir
2. Gali lubang 1 meter (lebar) dikali 2 (dalam). Dasar lubang harus berada 2 meter di bawah permukaan air
3. Tutup dengan 15 – 30 centi meter tanah tiap hari (maksimal timbunan tanah 30 centi meter)
4. Buat pagar untuk mencegah manusia atau hewan memasuki lokasi tersebut.